A síndrome do intestino irritável (SII) define-se pela presença dor abdominal associada a alteração do trânsito intestinal (diarreia ou obstipação).
A SII é uma entidade muito frequente, estimando-se que afete 10% da população, com predomínio do sexo feminino. Tem uma evolução benigna, com sobrevida semelhante à população em geral.
Apesar de não existirem complicações a longo prazo, a SII está associada a diminuição significativa da qualidade de vida, com absentismo laboral, consumo de recursos de saúde como consultas e exames.
A causa da SII não é completamente conhecida, mas sabe-se que vários fatores contribuem como alteração da motilidade, hipersensibilidade visceral (aumento da perceção da dor), aumento da permeabilidade visceral, sobrecrescimento bacteriano, predisposição genética ou o stress.
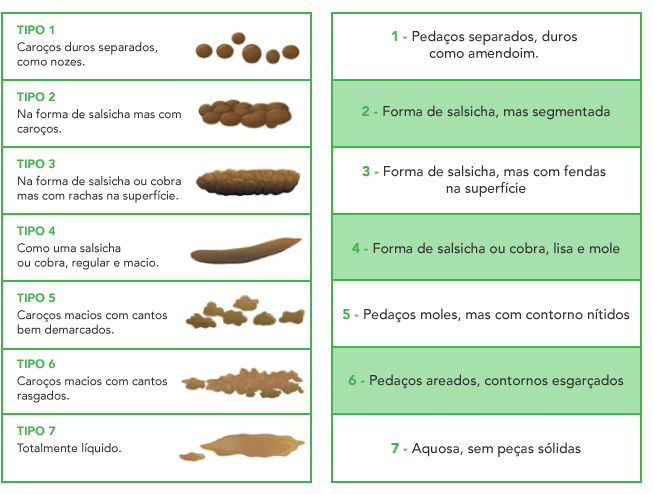
A SII manifesta-se por dor abdominal (presente em todos os casos) e alteração dos hábitos intestinais (diarreia, obstipação, ou ambas em alternância).
A dor abdominal é muito variável em intensidade e localização e está associada com a defecação, podendo agravar ou aliviar. As refeições e o stress podem exacerbar a dor.
O diagnóstico de SII requer a presença de um conjunto de critérios (critérios de Roma IV) e uma avaliação dirigida para excluir doença orgânica. Os critérios de Roma IV para diagnóstico de SII são os seguintes: dor abdominal recorrente frequente (um dia por semana nos últimos três meses), associada a dois dos três:
i) relacionada com as defecações
ii) associada a alteração da consistência das fezes
iii) associada a alteração da frequência das defecações.
Existem quatro subtipos principais de SII: SII com predomínio de diarreia (SII-D), SII com predomínio de obstipação (SII-C), SII misto (SII-M) e SII não classificado (SII-U), quando os doentes preenchem critérios de SII mas os hábitos intestinais não podem ser categorizados em nenhum dos três grupos acima descritos.
A exclusão de causas orgânicas (cancro colorretal, doença inflamatória do intestino) é obrigatória em doentes com sintomatologia sugestiva de síndrome de intestino irritável, mas com presença de sinais de alarme nomeadamente:
• início dos sintomas acima dos 50 anos
• perda de peso
• sangue nas fezes
• diarreia noturna
• dor de agravamento progressivo
• massa abdominal
• alterações laboratoriais (anemia, PCR ou calprotectina fecal aumentadas)
A abordagem da SII passa por explicar ao doente a benignidade da situação. O estabelecimento de uma boa relação médico doente é fundamental nesta entidade, estando associada a melhoria dos sintomas.
A dieta pode ter um papel importante. O aumento de fibra solúvel, a redução de lacticínios ou alimentos ricos em FODMAPS (acrónimo de Fermentable Oligossacharides, Dissacharides, Monossacharides And PoliolS), isto é, fibras não absorvíveis.
A terapêutica farmacológica inclui anticolinérgicos (butilescopolamina, mebeverina) na SII-dor, laxantes na SII-obstipação, antidiarreicos no SII-diarreia.
Alguns probióticos têm demonstrado melhoria dos sintomas da SII-dor. A rifaximina, um antibiótico não absorvível, demonstrou ser eficaz numa variedade de sintomas da SII como a dor, a flatulência e a consistência das fezes e a sua eficácia persistiu após o final do tratamento.
Os ansiolíticos como a amitriptilina em dose baixa (SII-dor), os IRSS como a sertralina ou fluoxetina (SII-obstipação) ou a trazodona (SII-diarreia) estão indicados em casos mais graves ou que não respondem às medidas terapêuticas instituídas. A psicoterapia também poderá estar indicada.
Ref:
• Rome IV-Functional GI Disorders: Disorders of Gut-Brain Interaction. Drossman DA, Hasler WL. Gastroenterology 2016; 150:1257-61
• Halmos EP, Power VA, Shepherd SJ, et al. A diet low in FODMAPs reduces symptoms of irritable bowel syndrome
• Pimentel M et al. Rifaximin Therapy for Patients with Irritable Bowel Syndrome without Constipation. N Engl J Med 2011; 364:22-32
• Dai C et al. Probiotics and irritable bowel syndrome. World J Gastroenterol 2013 Sep 28;19:5973–5980